À la pointe de la recherche en biologie cellulaire avec Marie-Hélène Verlhac
Marie-Hélène Verlhac, biologiste et directrice du Centre interdisciplinaire de recherche en biologie (CIRB) du Collège de France a reçu la médaille d’argent du CNRS en 2021. Spécialiste des étapes ultimes du développement ovocytaire, ses découvertes récentes permettent non seulement de mieux comprendre les mécanismes de l’embryon, mais ouvrent aussi de nouvelles voies pour la recherche sur le cancer. Elle nous présente ses projets de recherche menés avec le soutien de la Fondation du Collège de France et du Fonds Saint-Michel.
Pouvez-vous nous présenter le Centre interdisciplinaire de recherche en biologie du Collège de France que vous dirigez ?
Le CIRB a été créé en parfaite adéquation avec la doctrine du Collège de France, Docet Omnia, avec pour objectif de faire se rencontrer et de favoriser le dialogue entre une large variété de disciplines intéressées par une vision intégrée du monde vivant. Le CIRB n’est donc pas un centre de recherche centré autour d’une thématique principale. Les recherches menées par les 18 équipes qui constituent le CIRB sont extrêmement riches et s’appuient souvent sur des approches au carrefour de plusieurs disciplines : mathématiques, physique, médecine et biologie. Ainsi nous essayons de comprendre comment les êtres vivants utilisent et transforment l’énergie dont ils disposent dans leur environnement, qu’elle soit chimique, mécanique, lumineuse ou autre. Nous souhaitons appréhender la façon dont les oiseaux acquièrent leur patron de plumage spécifique, dont certaines bactéries évoluent pour devenir pathogènes, se propageant au sein des organes, comprendre comment les neurones communiquent entre eux et avec leurs cellules voisines comme les astrocytes, comment les propriétés mécaniques des cellules isolées ou au sein des tissus influent sur leur devenir sain ou cancéreux, jusqu’à appréhender la façon dont l’architecture de réseaux neuronaux participe à la mémoire procédurale et visuelle. La force de la recherche faite au CIRB repose donc sur cette diversité des questions biologiques abordées, combinée à une méthodologie interdisciplinaire. La contrepartie d’une absence de thématique commune centrée sur une fonction, un organe ou une maladie spécifique dans les recherches menées au CIRB est un engagement, une curiosité nécessaire de la part des équipes vers toutes les sciences.
Vous développez un champ de recherche récent en biologie cellulaire, la « mécanostransduction », phénomène impliqué dans la compréhension globale des mécanismes de l’embryon. Pouvez-vous nous en dire un peu plus ?
L’observation de la transformation d’un signal mécanique en un signal électrique a été faite il y a assez longtemps notamment grâce à l’étude du fonctionnement des cellules de l’oreille interne. Néanmoins la compréhension des mécanismes qui assurent la transformation d’une information mécanique en une information à l’échelle du noyau cellulaire est plus récente et constitue une discipline actuellement en plein essor. Ces mécanismes sont à l’œuvre dans les embryons en développement, dans l’homéostasie des tissues ou dans des pathologies comme le cancer. Ils permettent la constitution d’un dialogue entre forces intracellulaire et/ou intercellulaire et noyau, pouvant impacter la forme du noyau et l’expression de son génome. Cependant, on peut imaginer des situations où, au contraire, les cellules veulent échapper aux contraintes mécaniques environnementales. Par exemple lorsque des cellules métastatiques se déforment lors du passage à travers la paroi des vaisseaux sanguins. C’est précisément cette question que nous souhaitons désormais aborder avec le soutien de la Fondation du Collège de France et du Fonds Saint-Michel.
De quelle manière l’étude de ce mécanisme permet aussi de faire avancer la recherche sur les processus cancéreux ?
Les anomalies morphologiques sont utilisées depuis le siècle dernier dans le diagnostic du cancer pour distinguer les cellules bénignes des cellules malignes. L’un des tests les plus célèbres pour le diagnostic du cancer, le “test Pap” mis au point par George Papanicolaou, repose sur la détection de changements morphologiques dans les cellules du col de l’utérus et contribue toujours à la prévention de ce type de cancer. Les avancées technologiques récentes permettent désormais la détection automatisée des cellules cancéreuses sur la base de critères morphologiques. Les changements morphologiques des cellules cancéreuses comprennent l’altération de la forme nucléaire, l’altération de l’organisation de la chromatine et les altérations au niveau de l’expression des gènes. Parmi les exemples d’anomalies morphologiques nucléaires, citons les noyaux des cellules de carcinome pulmonaire à grandes cellules, qui présentent des plis et des invaginations, et les noyaux des cellules de carcinome thyroïdien papillaire, qui présentent des rainures et de longues fentes. Malgré les énormes progrès réalisés ces dernières années dans la compréhension de l’architecture nucléaire, les origines des défauts morphologiques des cellules cancéreuses restent inconnues. On ne sait pas non plus dans quelle mesure la forme anormale des noyaux cancéreux peut affecter l’expression de leur génome. Les contraintes mécaniques imposées par l’environnement cellulaire par le biais du cytosquelette peuvent en effet impacter non seulement la forme des noyaux des cellules tumorales mais aussi l’intérieur de ce dernier, ce phénomène étant qualifié de « mécanotransduction ». Il apparait donc fondamental d’étudier ce phénomène de mecanotransduction afin d’appréhender de nombreux mécanismes à l’œuvre dans les cellules tumorales.
En 2021 et 2022, vous avez été soutenue par la Fondation du Collège de France et le Fonds Saint-Michel. Qu’est-ce que ces deux années de recherche vous ont permis de mettre en place ?
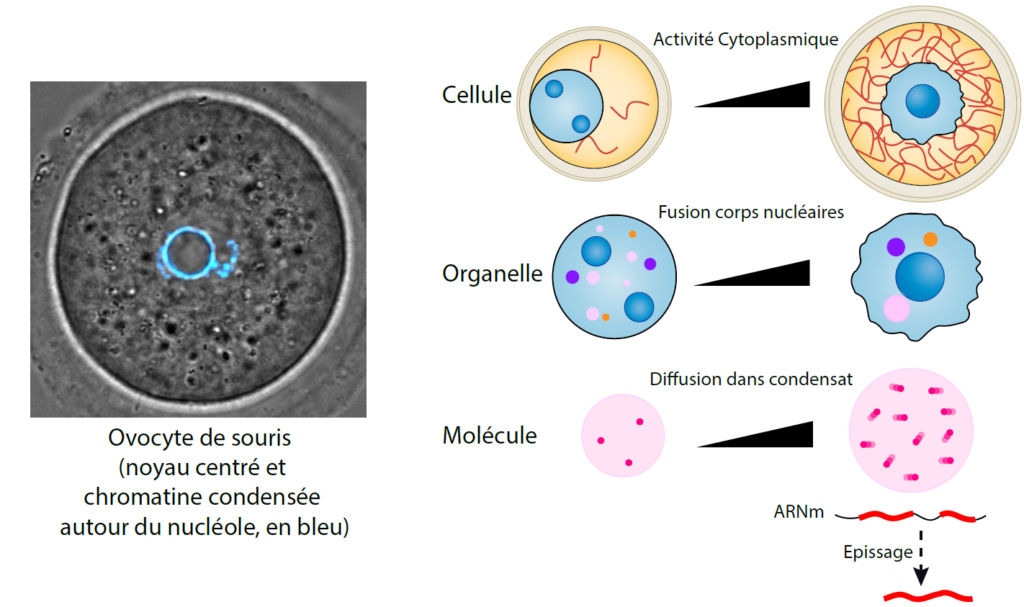
Par le passé, nous avions démontré en quoi l’ovocyte de souris constitue un modèle original et pertinent permettant la découverte de mécanismes caractéristiques de certaines cellules cancéreuses, comme la capacité à ramollir le cortex cellulaire, à rassembler les centres organisateurs de microtubules multiples aux pôles des fuseaux, à l’image des tumeurs solides avec centrosomes surnuméraires, ou encore à faire des divisions à fort taux d’erreurs numériques et structurales des chromosomes. Plus récemment, nous avions découvert un modèle unique de mécanotransduction où les forces du cytosquelette d’actine, générant une activité cytoplasmique globale, s’exercent directement sur le noyau, modulant sa forme et l’expression des gènes.
Avec le soutien de la Fondation du Collège de France et du Fonds Saint-Michel, de la Fondation pour la Recherche Médicale et de l’Agence nationale de la recherche, nous souhaitions étudier comment les informations mécaniques de l’environnement sont transmises à l’intérieur des cellules jusqu’au noyau (phénomène de mécanotransduction), pouvant ainsi affecter l’expression de leur génome. Ce projet de recherche fondamentale avait pour intention notamment d’identifier des causes possibles des altérations des corps nucléaires, observées dans de nombreux cancers. Par une approche interdisciplinaire, nous avons découvert que les ovocytes de souris développent des forces mécaniques issues du cytosquelette lors de leur croissance dans les ovaires, afin de réorganiser des organelles nucléaires appelés condensats, et en particulier les corps d’épissage (« nuclear speckles »). Sans cette réorganisation, l’épissage des stocks d’ARN messagers maternels est dérégulé, conduisant à des divisions ovocytaires défaillantes et ainsi, impactant la fécondité du gamète. Au-delà de la reproduction, ce mécanisme apporte un éclairage nouveau à de nombreuses anomalies liées à des défauts de forces cytoplasmiques corrélant avec des défauts d’architecture des condensats, observés dans les cancers, les maladies neurodégénératives et les infections virales. Ce travail a été récemment publié (1) et a fait l’objet de plusieurs actualités, notamment dans des journaux comme Le Monde (2) ou La Recherche (article en cours d’édition).
Référence :
(1) Al Jord A*, Letort G, Chanet S, Tsai FC, Antoniewski C, Eichmuller A, Da Silva C, Huynh JR, Gov NS, Voituriez R, Terret ME, Verlhac MH. (2022). Cytoplasmic forces functionally reorganize nuclear condensates in oocytes. Nat Commun 13: 5070
(2) « L’agitation du noyau, clé du développement de la cellule» de David Larousserie, Le Monde du 18/10/2022. (Voir l’article)














![[VIDÉO] Faiseurs d’histoire](https://collegedefrance.dev7.ydu.fr/wp-content/uploads/2022/04/Entre-vues_Def-700x470-1-480x400.png)

![[VIDÉO] Comment s’arrêtent les pandémies ?](https://collegedefrance.dev7.ydu.fr/wp-content/uploads/2022/04/masque-rue-480x400.jpeg)